4. Système de perfusion et de collection
Les pipettes de Sylgard, de soutien, de perfusion et de collections, sont façonnées à partir de cannes de verre grâce à une forge. La forge est formée d’un mandrin qui maintient la canne de verre à la verticale et d’un barillet portant 6 filaments différents par leur forme et leur matière (kanthal©, platine). Un générateur électrique muni d’un variateur permet de faire tourner le mandrin et de chauffer les filaments. Une loupe grossissant jusqu’à 80 fois permet de suivre toutes les étapes de fabrication des pipettes avec beaucoup de précision. Ainsi, le verre, chauffé jusqu’à son point de fusion par les filaments, s’amincie en s’étirant lorsqu’un poids est suspendu à la canne de verre. Sans poids, le verre forme un épaississement. Une pipette de soutien doit avoir une ouverture de la même taille que le diamètre externe des tubules, soit de 45 à 60 μm pour les canaux collecteurs et 35 à 45 μm pour les branches larges de l’anse de Henle. Le diamètre de la constriction est de 15 à 20 μm et le diamètre externe des pipettes de perfusion n’est que de 10 μm (figure 4). Les pipettes de collection sont aussi très soigneusement fabriquées pour avoir des volumes adaptés au recueil d’échantillons. Elles ont une pointe en forme ovoïde délimitée par une constriction de 5 à 10 μm, une bouche de 20 à 30 μm et un diamètre maximal de 160 μm pour une longueur de 750μm pour un volume d’environ 25 nl (figure 5).
4.1. Pipettes côté perfusion
Du coté perfusion, il y a quatre pipettes imbriquées les unes dans les autres (figure 4). Chaque pipette est maintenue dans un bloc en plastique posé sur des modules reliés entre eux par des deux tiges métalliques. La pipette la plus fine est positionnée dans la pipette de taille supérieure sous loupe binoculaire. Les deux plus grosses pipettes sont centrées par rapport à la pipette de perfusion grâce à des vis déplaçant des roues de centrage. Le set de pipettes est ensuite monté sur un micromanipulateur et les pipettes sont amenées au fond de la chambre de perfusion avec beaucoup de précaution. Le tubule est maintenu par une pipette de soutien (soutien perfusion) qui a une constriction à la bouche permettant de le maintenir dans l’axe de la pipette de perfusion. La pipette de perfusion, qui est maintenue sur un bloc mobile, est avancée dans le tubule par l’action d’une roue crantée actionnant une vis sur laquelle se déplace le module; une fois positionnée, elle sort d’une centaine de micromètres de la pipette de soutien. Le perfusât arrive à la tête de la pipette de perfusion par la pipette dite de « fluid exchange », une fine pipette en verre tressé reliée par des cathéters à la seringue d’injection. Le perfusât est poussé dans le tubule par pression hydrostatique (PH) grâce à une colonne d’eau contenue dans une seringue de 50 ml suspendue à une hauteur modulable. Au cours de l’expérience, il est possible de changer de perfusât par la pipette de fluid exchange. Le premier perfusât est chassé par une voie de purge située à l’arrière de la perfusion, dans le bloc en plastique qui l’enchâsse. Une quatrième pipette contient les trois pipettes précédentes et est remplie d’un liquide iso-électrique (le Sylgard) qui permet d’isoler le bain de la solution de perfusion. Lorsque le tubule est monté et que la perfusion est installée, la pipette de Sylgard est avancée jusqu'à ce que le Sylgard tombe sur le tubule pour isoler l’intérieur du tubule du bain.
 |
| FIGURE 4 |
Le tubule est maintenu par la pipette de soutien qui a une constriction à son extrêmité. La pipette de perfusion est avan-cée dans le tubule et délivre le perfusât sous la pression hydrostatique formée par une colonne d’eau. Le perfusât est amené jusqu’à la tête de la pipette de perfusion par la pipette de « fluid exchange » (en orange). La pipette de Sylgard contient les autres pipettes et est remplie de Sylgard (en gris). Le Sylgard repose sur le tubule et isole électriquement le bain de la perfusion
4.2. Pipettes côté collection
Du coté collection, il y a trois pipettes (figure 5) : Une pipette de soutien collection qui maintient le tubule ; une pipette de Sylgard et une pipette de collection qui à une constriction délimitant un volume connu. Lorsque le tubule est en place, la pipette de Sylgard est avancée par-dessus la pipette de collection pour que le Sylgard tombe sur le tubule et isole le liquide perfusé du bain. Pour garder le tubule ouvert sous la pression du Sylgard, une colonne d’huile de 2 cm est ajoutée dans la pipette de soutien collection. En opposant une résistance à la pression hydrostatique, elle oblige le tubule à rester ouvert. Le liquide collecté monte dans la pipette de soutien collection en repoussant l'huile. La pipette de collection est placée délicatement à l'intérieur de la pipette de soutien. Une fois fixée à un support mobile, la pipette de collection est avancée jusqu'à la tête de la pipette de soutien à l’aide d’un moteur relié au support. Des échantillons de liquide perfusé sont alors collectés et le temps nécessaire à chaque collection est mesuré.
 |
| FIGURE 5 |
Le tubule est maintenu par une pipette de soutien n’ayant pas de constriction mais dont la bouche est de diamètre égal à celui du tubule. La pipette de Sylgard contient la pipette de soutien et est remplie de Sylgard (gris). Le Sylgard permet d’isoler électriquement le bain (sans couleur) du liquide qui sort du tubule (collection, en bleu). Le liquide de collection monte le long de la pipette de soutien en repoussant la colonne d’huile qu’elle contient (jaune). Une pipette de collection est introduite dans la pipette de soutien pour recueillir des échantillons du liquide de collection. Ces échantillons s’accumulent dans la pipette et sont séparés par des gouttes d’huile.
4.3. Système de perfusion
Le liquide perfusé entre dans le système par la seringue (rouge) et passe par un filtre (0.4 µm hydrophile). Le liquide passe dans la vanne d'injection et dans la pipette de fluid exchange (orange). arrivée à la pointe de la pipette de perfusion, le liquide remonte le long de la fluide exchange (en bleu) pour ressortir par deux voies possibles : une reliée au voltmètre et l'autre relié à la purge.
Pour changer le fluide à perfusé, il faut ouvrir la vanne de purge et mettre la vanne d'arrivée en position seringue vers fluide exchange. Il faut environ 600 µl pour purger le liquide à perfuser (très pratique pour les drogues qui coûtent cher). Ensuite pour déclencher la perfusion, il faut fermer la vanne de purge et mettre la vanne d'arrivée en mode pression hydrostatique vers fluide exchange. Ainsi, c'est la hauteur de colonne d'eau qui jouera sur le débit par la perfusion.
Il faut penser à purger le petit tube reliant le liquide de perfusion au voltmètre en début d'expérience mais il n'est pas nécessaire de purger ce tube avec les liquides de perfusions successifs par la suite.
4.4. Système de bain
Le liquide bain est stocké dans les réservoirs. On peut avoir un réservoir contrôle et l'autre contenant une drogue. On peut choisir de quel réservoir s'écoulera le bain grâce à l'arrivée 6 voies. Le bain s'écoule dans une jaquette (chauffée par l'eau du bain Marie ou auto-chauffante) puis arrive dansla chambre du microscope où sera déposé puis perfusé le tubule. Le bain est aspiré par une pompe (électrique donc située hors de la cage de Faraday) puis termine dans une poubelle. En cas de faible volume de bain (drogue qui coûte chère), le bain peut être recyclé et ré-envoyé dans un réservoir.
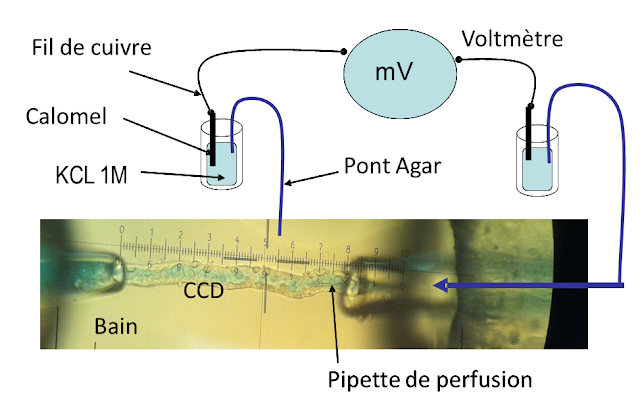
5. Système de mesure de la différence de potentiel transépithélial (DPte)
Le bain et la solution de perfusion sont reliés respectivement à l'anode et à la cathode d’un millivoltmètre (Ampel) par deux ponts Agar/NaCl 150 mM qui plongent chacun dans une solution de KCl 1M où baigne un calomel (AgCl) (figure 6). Avant de monter le tubule, la valeur affichée par le voltmètre, correspondant à la différence de potentiel existant entre les deux calomels, est notée : elle sera soustraite des valeurs obtenues une fois le tubule monté. Cette valeur de base ne doit pas être supérieure à 10 mV et doit rester stable du début à la fin de l’expérience. Dans un cas contraire, le voltage mesuré ne donne qu’une indication mais ne peut être utilisé pour être comparé aux mesures de DPte d'autres expériences. La DPte peut être enregistrée en continu pendant toute l’expérience.



Excellent post, tout à fait ce que je voulais trouver.
RépondreSupprimerIV Set fabriqué par Lars Medicare est exporté dans plus de 100 pays. La qualité des ensembles IV est conforme à la norme de qualité internationale. Il est composé de PVC (chlorure de polyvinyle) de haute qualité.
Please visit: https://www.larsmedicare.com/
Safety IV Cannula | Infusion Therapy | Hypodermic Syringe| | AV Fistula Needle | Safety Goggles | Air Bed Mattress | Nebulizer Machine | Latex Examination Gloves | Latex Surgical Gloves | Latex Gynaecological Gloves | Spinal Needle |